Nutrição, Exercício Físico e Microbiota Vaginal: Evidências Científicas, Exemplos Práticos e Implicações para Infecções
- henriquedagger
- 28 de out. de 2025
- 14 min de leitura
A Relevância da Microbiota Vaginal no Contexto do Estilo de Vida
A crescente compreensão do microbioma humano tem revolucionado a forma como percebemos a saúde e a doença, revelando que os ecossistemas microbianos são parceiros integrais na fisiologia do hospedeiro (KOCHHAR; MARTIN, 2015). Nesse contexto, fatores de estilo de vida modificáveis, como a dieta e a prática de exercícios físicos, emergem como moduladores cruciais, capazes de influenciar a composição e a atividade metabólica dessas comunidades (BERMON et al., 2015). Embora a microbiota intestinal tenha recebido a maior parte da atenção científica, outros nichos, como o vaginal, são igualmente vitais para o bem-estar geral.
A microbiota vaginal (MV, vaginal microbiota – VM) é definida como a comunidade de microrganismos que habita o trato genital feminino, funcionando como a primeira linha de defesa contra a colonização por patógenos oportunistas e sexualmente transmissíveis (MENDLING, 2016). A manutenção de um ecossistema vaginal saudável é, portanto, indispensável para a saúde reprodutiva e para a qualidade de vida da mulher, sendo um componente-chave na prevenção de infecções e na promoção da homeostase local (NIBALI; HENDERSON, 2016).
Um ecossistema vaginal equilibrado é caracterizado pela dominância de espécies de Lactobacillus, que metabolizam o glicogênio do epitélio vaginal para produzir ácido lático, mantendo um pH vaginal (pHv) ácido, tipicamente inferior a 4.5 (HOLDCROFT; PAYNE; IRELAND, 2023). Este ambiente ácido inibe o crescimento de microrganismos patogênicos e previne condições comuns e recorrentes como a vaginose bacteriana (VB, bacterial vaginosis – BV), uma disbiose caracterizada pela substituição dos lactobacilos por uma flora polimicrobiana de anaeróbios, e a candidíase vulvovaginal (MENDLING, 2016).

A premissa central deste artigo é avaliar, com base nas evidências científicas disponíveis, como a nutrição e a atividade física (AF, physical activity – PA) — fatores modificáveis e intrínsecos ao cotidiano — influenciam a composição e a função da MV (HOLDCROFT; PAYNE; IRELAND, 2023). Compreender essas interações é de suma importância, pois posiciona o estilo de vida como um alvo estratégico para a promoção da saúde ginecológica e a prevenção de disbioses, oferecendo abordagens complementares e de baixo custo para a manutenção do bem-estar feminino (BERMON et al., 2015). Essa análise aprofundada da influência do estilo de vida nos prepara para compreender a ecologia detalhada de uma microbiota vaginal saudável.
A Ecologia da Microbiota Vaginal Saudável: Um Ecossistema Dominado por Lactobacillus
A microbiota vaginal saudável deve ser entendida como um ecossistema finamente equilibrado, cuja estabilidade é fundamental para a proteção do hospedeiro contra infecções e para a manutenção da saúde reprodutiva (MENDLING, 2016). A característica mais distintiva desse ecossistema, em contraste com a alta diversidade encontrada no intestino, é justamente sua baixa diversidade, com o domínio de uma ou poucas espécies do gênero Lactobacillus (RAVEL et al., 2011).
Estudos de larga escala que utilizaram sequenciamento de nova geração identificaram diferentes tipos de comunidades vaginais saudáveis (community state types – CSTs), a maioria delas dominada por espécies como Lactobacillus crispatus (L. crispatus), L. gasseri, L. jensenii ou L. iners (MENDLING, 2016). Essas espécies são consideradas guardiãs do ecossistema vaginal, exercendo uma poderosa função protetora que mantém a homeostase e previne a proliferação de patógenos (RAVEL et al., 2011).
O principal mecanismo de proteção conferido pelos lactobacilos é a produção de ácido lático através da fermentação do glicogênio, um polissacarídeo armazenado nas células epiteliais vaginais (HOLDCROFT; PAYNE; IRELAND, 2023). Essa produção contínua de ácido lático é responsável pela manutenção de um pHv ácido (geralmente < 4.5), que cria um ambiente hostil para a maioria dos microrganismos patogênicos, incluindo aqueles associados à VB e outras infecções (MARCHESI, 2014).
Além da acidificação do ambiente, os lactobacilos empregam outros mecanismos de defesa sofisticados (MENDLING, 2016). Muitas cepas produzem peróxido de hidrogênio (H₂O₂), uma molécula com potente atividade antimicrobiana, e bacteriocinas, que são peptídeos que inibem ou matam outras bactérias (RESTA-LENART; BARRETT, 2003). Adicionalmente, eles produzem biossurfactantes que interferem na adesão dos patógenos à mucosa vaginal, prevenindo a formação de biofilmes nocivos (MENDLING, 2016).
A estabilidade desse ecossistema é fortemente influenciada por fatores fisiológicos do hospedeiro, principalmente os níveis de estrogênio (HOLDCROFT; PAYNE; IRELAND, 2023). Durante o ciclo menstrual, os picos de estrogênio promovem o amadurecimento e a proliferação das células epiteliais vaginais, aumentando os estoques de glicogênio. Essa maior disponibilidade de substrato favorece o crescimento dos lactobacilos e reforça as defesas do ambiente vaginal (HOLDCROFT; PAYNE; IRELAND, 2023). Essa dependência direta do glicogênio, um carboidrato, serve como uma ponte clara para entender a influência mais ampla que a dieta exerce sobre a saúde vaginal.
Nutrição e Microbiota Vaginal: O que a Literatura Científica Indica
A dieta é reconhecida como um dos principais fatores ambientais que modulam os ecossistemas microbianos do corpo, com evidências robustas demonstrando sua capacidade de alterar a composição e a função da microbiota intestinal (SCOTT et al., 2013). Embora a pesquisa sobre a MV seja mais recente, um corpo crescente de evidências aponta para uma conexão igualmente forte, sugerindo que as escolhas alimentares podem impactar diretamente a saúde do ambiente vaginal (HOLDCROFT; PAYNE; IRELAND, 2023).

O Impacto dos Macronutrientes e Padrões Alimentares
Os carboidratos desempenham um papel dual na modulação da MV, e seus efeitos dependem fundamentalmente de sua complexidade e qualidade (HOLDCROFT; PAYNE; IRELAND, 2023). Por um lado, carboidratos complexos e fibras alimentares, encontrados em grãos integrais, leguminosas e vegetais, podem fornecer substratos para o crescimento de Lactobacillus spp. (SLAVIN, 2013). Por outro lado, dietas ricas em carboidratos de alto índice glicêmico (IG, glycemic index - GI) e alta carga glicêmica (CG, glycemic load - GL), como os presentes em açúcares refinados e farinhas brancas, foram associadas a um risco significativamente aumentado de desenvolver VB (HOLDCROFT; PAYNE; IRELAND, 2023).
A ingestão de gorduras também parece ser um fator relevante. Um estudo que acompanhou mais de 1.500 mulheres encontrou uma associação positiva entre uma alta ingestão de gorduras, especialmente as saturadas, e um maior risco de VB (NEGGERS et al., 2007). Essa correlação sugere que a qualidade da gordura na dieta, e não apenas a quantidade, pode influenciar o equilíbrio do ecossistema vaginal (HOLDCROFT; PAYNE; IRELAND, 2023).
Quando analisados em conjunto, os padrões alimentares revelam tendências claras. Dietas caracterizadas por alto consumo de grãos refinados, doces e alimentos processados estão consistentemente associadas a estados de disbiose, não apenas no intestino, mas também com implicações para a saúde vaginal (MORVARID et al., 2022). Em contrapartida, padrões alimentares ricos em fibras, frutas e vegetais, característicos de uma dieta mediterrânea ou baseada em plantas, parecem promover um microbioma mais saudável e resiliente (DE FILIPPO et al., 2010).
Compostos Bioativos: O Papel de Fibras e Polifenóis
As fibras alimentares, particularmente as solúveis, atuam como prebióticos, que são substratos não digeríveis que estimulam seletivamente o crescimento de bactérias benéficas no cólon (SLAVIN, 2013). A fermentação dessas fibras pela microbiota intestinal resulta na produção de ácidos graxos de cadeia curta (AGCC, short-chain fatty acids – SCFAs), como acetato, propionato e butirato (PARKE et al., 2015).
Embora a produção de AGCC ocorra primariamente no intestino, esses metabólitos são absorvidos pela corrente sanguínea e exercem efeitos sistêmicos em todo o corpo (SHENDEROV, 2016). Os AGCC são conhecidos por suas propriedades anti-inflamatórias, pela sua capacidade de fortalecer a integridade da barreira epitelial e por modular a função imune (KOCHHAR; MARTIN, 2015). Considerando que a mucosa vaginal, assim como outros tecidos, é suscetível ao estado inflamatório sistêmico, a redução dessa inflamação de baixo grau representa um mecanismo plausível e sistêmico pelo qual a dieta intestinalmente ativa impacta a saúde ginecológica (SHENDEROV, 2016).
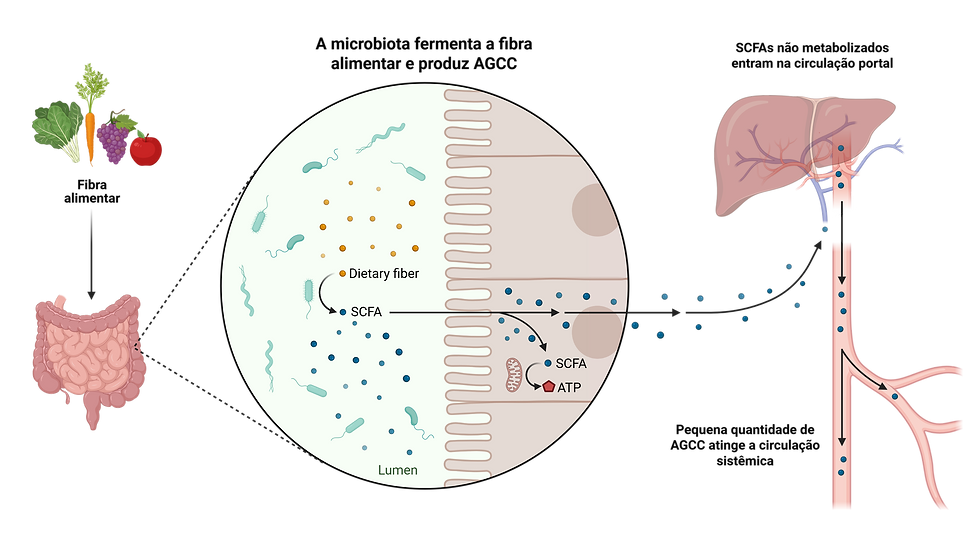
Os polifenóis, compostos bioativos encontrados em abundância em plantas, frutas, vegetais, chá e azeite de oliva, também são metabolizados pela microbiota intestinal, gerando metabólitos secundários com potentes propriedades antioxidantes e anti-inflamatórias (MIHALEVA; ROSS; MOCO, 2015). Essa modulação da inflamação sistêmica pode ser outro mecanismo indireto pelo qual uma dieta rica em plantas contribui para a saúde vaginal (ANTONIO; ORTIZ-ALVAREZ; JÄGER, 2020). Fica claro que, para além dos macronutrientes, a ingestão adequada de micronutrientes é igualmente vital para a manutenção da saúde da MV.
Micronutrientes e a Saúde da Microbiota Vaginal
Os micronutrientes, como vitaminas e minerais, são cofatores essenciais para inúmeras reações enzimáticas e desempenham um papel crucial na manutenção da função imunológica e na integridade das barreiras epiteliais do hospedeiro (NEGGERS et al., 2007). A deficiência desses compostos pode comprometer as defesas do organismo, criando um ambiente mais suscetível a disbioses e infecções, incluindo aquelas que afetam o trato vaginal (HOLDCROFT; PAYNE; IRELAND, 2023).
Evidências epidemiológicas consistentes associam a ingestão insuficiente de várias vitaminas a um risco aumentado de desenvolver VB (HOLDCROFT; PAYNE; IRELAND, 2023). Especificamente, baixos níveis de ingestão de vitaminas A, C, D, E, folato e cálcio foram correlacionados com uma maior prevalência dessa condição disbiótica (HOLDCROFT; PAYNE; IRELAND, 2023).
Dentre as vitaminas, a vitamina D merece destaque por seu papel bem estabelecido na modulação da imunidade da mucosa (HOLDCROFT; PAYNE; IRELAND, 2023). Adicionalmente, um estudo demonstrou que uma maior ingestão de vitamina E, folato e cálcio estava associada a uma redução de até 60% no risco de desenvolver VB severa, reforçando a importância desses nutrientes para a estabilidade do ecossistema vaginal (NEGGERS et al., 2007).
Uma das associações mais fortes encontradas na literatura é entre a deficiência de ferro e o risco de VB, especialmente durante a gravidez (VERSTRAELEN et al., 2005). A deficiência subclínica de ferro, mesmo sem anemia manifesta, foi identificada como um forte preditor de VB em gestantes, destacando a importância de garantir um estado nutricional adequado de ferro para a saúde ginecológica durante esse período crítico (MORVARID et al., 2022). A partir da compreensão do papel da dieta, o próximo passo lógico é explorar intervenções mais diretas, como o uso de probióticos e prebióticos, para modular ativamente a microbiota.
Probióticos e Prebióticos: Estratégias Terapêuticas Direcionadas
Além da dieta como um modulador geral, estratégias mais direcionadas, como o uso de probióticos e prebióticos, têm ganhado destaque por sua capacidade de restaurar ou reforçar um ecossistema microbiano saudável (SLAVIN, 2013). Essas abordagens são particularmente relevantes para a saúde vaginal, onde a dominância de um grupo específico de bactérias, os lactobacilos, é crucial para a homeostase (MENDLING, 2016).
Probióticos para a Saúde Vaginal
O uso de probióticos, definidos como microrganismos vivos que, quando administrados em quantidades adequadas, conferem um benefício à saúde do hospedeiro, baseia-se na lógica de reintroduzir ou reforçar populações de bactérias benéficas (MENDLING, 2016). Para a saúde vaginal, as cepas de Lactobacillus são as mais estudadas e utilizadas, visando combater disbioses como a VB. Os mecanismos de ação incluem a competição direta com patógenos por nutrientes e por sítios de adesão na mucosa vaginal, além da produção ativa de compostos antimicrobianos como ácido lático, H₂O₂ e bacteriocinas (RESTA-LENART; BARRETT, 2003).
O sucesso das formulações probióticas, no entanto, enfrenta desafios significativos. Para garantir a eficácia, é crucial que o produto contenha um número adequado de unidades formadoras de colônias (UFCs), geralmente na ordem de 10⁶ a 10⁷ por dose, e que a viabilidade dessas bactérias vivas seja mantida desde a fabricação até o momento do consumo e sua chegada ao local de ação (ADAMS, 2018). Fatores como armazenamento inadequado e a passagem pelo ambiente ácido do estômago podem comprometer a eficácia do produto final (ADAMS, 2018).
Prebióticos como Combustível para a Flora Benéfica
Prebióticos são definidos como carboidratos não digeríveis que estimulam seletivamente o crescimento e/ou a atividade de bactérias benéficas já residentes no organismo (SLAVIN, 2013). Exemplos comuns incluem a inulina, os fruto-oligossacarídeos (FOS) e os galacto-oligossacarídeos (GOS), que servem como "combustível" preferencial para gêneros como Lactobacillus e Bifidobacterium (LYTE; CRYAN, 2016).

Ao contrário dos probióticos, que introduzem bactérias exógenas, os prebióticos atuam fortalecendo a população de lactobacilos vaginais endógenos (KOLIDA; GIBSON, 2007). Ao fornecer o substrato ideal para essas bactérias, a suplementação com prebióticos pode aumentar a produção de ácido lático, acidificar o pHv e, consequentemente, reforçar as defesas naturais do ecossistema vaginal contra a invasão de patógenos (KOLIDA; GIBSON, 2007). Enquanto essas intervenções modulam a microbiota diretamente, outra variável importante do estilo de vida, o exercício físico, exerce sua influência por vias mais sistêmicas e indiretas.
Exercício Físico como Modulador da Microbiota Vaginal
Embora a pesquisa sobre o efeito direto do exercício físico na MV ainda seja incipiente, as evidências robustas de seus efeitos benéficos na microbiota intestinal e nos sistemas fisiológicos do hospedeiro permitem inferir mecanismos indiretos de grande relevância para a saúde vaginal (BERMON et al., 2015). A prática de atividade física regular modula o ambiente sistêmico, criando condições mais favoráveis para a manutenção de ecossistemas microbianos saudáveis em todo o corpo (PRIETO et al., 2024).
Mecanismos Sistêmicos: Redução da Inflamação e Melhoria da Composição Corporal
Estudos demonstram consistentemente que a prática regular de AF está associada a uma maior diversidade microbiana no intestino e a uma maior abundância de bactérias produtoras de AGCC (ANTONIO; ORTIZ-ALVAREZ; JÄGER, 2020). Esses metabólitos, como o butirato, possuem potentes efeitos anti-inflamatórios que se estendem para além do intestino, ajudando a reduzir a inflamação sistêmica de baixo grau (PRIETO et al., 2024).
O principal mecanismo pelo qual o exercício provavelmente influencia a MV é indireto, mediado pela melhoria da composição corporal e pela modulação do estado inflamatório (BERMON et al., 2015). A redução do índice de massa corporal (IMC, body mass index – BMI) e da adiposidade visceral diminui a produção de citocinas pró-inflamatórias pelo tecido adiposo, criando um ambiente fisiológico mais favorável para a estabilidade da microbiota vaginal (QUEIPO-ORTUÑO et al., 2013).
Efeitos na Função de Barreira e Metabolismo
O exercício de intensidade moderada tem demonstrado fortalecer a função da barreira intestinal, diminuindo a permeabilidade e reduzindo a translocação de componentes bacterianos pró-inflamatórios, como o lipopolissacarídeo (LPS), para a circulação sanguínea (ANTONIO; ORTIZ-ALVAREZ; JÄGER, 2020). Essa redução da chamada "endotoxemia metabólica" contribui para a homeostase sistêmica. Tal benefício pode se refletir diretamente na saúde e integridade da mucosa vaginal, que é igualmente sensível ao estado inflamatório geral do corpo (ANTONIO; ORTIZ-ALVAREZ; JÄGER, 2020).
É crucial ressaltar que os benefícios do exercício na microbiota não são independentes da dieta. Padrões alimentares desequilibrados, como dietas com teor muito baixo de fibras ou excessivamente altas em proteínas e gorduras, podem anular ou até mesmo alterar negativamente os efeitos do exercício (JANG et al., 2019). Portanto, a sinergia entre uma dieta saudável e a prática regular de AF é fundamental para otimizar a modulação microbiana. Compreender esses mecanismos nos permite traduzir as evidências científicas em estratégias práticas e aplicáveis.
Implicações Práticas e Direções Futuras
A saúde vaginal não deve ser vista como um sistema isolado, mas sim como um reflexo da saúde geral e do estilo de vida do hospedeiro. As evidências apresentadas reforçam que estratégias de nutrição e exercício físico podem ser ferramentas poderosas e acessíveis para a manutenção de um ecossistema microbiano equilibrado. Essas abordagens marcam uma transição de um modelo reativo, focado no tratamento de infecções, para um paradigma proativo e preventivo, centrado em escolhas de estilo de vida para a manutenção da saúde ginecológica (NIBALI; HENDERSON, 2016).
Estratégias Nutricionais Aplicáveis
Aumentar o consumo de fibras prebióticas: Incluir alimentos como alho, cebola, aspargos, bananas, aveia, leguminosas e grãos integrais para fornecer substrato para o crescimento e a atividade dos lactobacilos vaginais (SLAVIN, 2013).
Priorizar carboidratos de baixo índice glicêmico: Substituir pães brancos, arroz branco, massas refinadas e doces por suas versões integrais, além de aumentar o consumo de leguminosas e vegetais. Isso ajuda a manter a glicemia estável e a evitar picos que podem favorecer disbioses como a VB (HOLDCROFT; PAYNE; IRELAND, 2023).
Incorporar fontes de gorduras saudáveis e polifenóis: Consumir regularmente azeite de oliva extra virgem, oleaginosas, sementes, frutas vermelhas, chá verde e vegetais de folhas escuras para modular a inflamação e fornecer antioxidantes (MIHALEVA; ROSS; MOCO, 2015).
Garantir a ingestão adequada de micronutrientes: Focar em fontes alimentares ricas em vitamina D (peixes gordurosos, exposição solar segura), folato (vegetais verdes escuros, feijões), cálcio (laticínios, gergelim) e ferro (carnes magras, leguminosas, vegetais verde-escuros) para apoiar a função imune e reduzir o risco de VB (NEGGERS et al., 2007; VERSTRAELEN et al., 2005).
Recomendações de Exercício Físico
Prática regular de atividade aeróbica moderada: Recomenda-se de 150 a 300 minutos por semana de atividades como caminhada rápida, corrida leve, ciclismo ou natação para promover a saúde cardiovascular e reduzir a inflamação sistêmica de baixo grau (PRIETO et al., 2024).
Treinamento de força: Incluir exercícios de musculação ou com o peso corporal de 2 a 3 vezes por semana é fundamental para melhorar a composição corporal, aumentar a massa magra e otimizar a sensibilidade à insulina, fatores que contribuem indiretamente para a saúde da MV (ANTONIO; ORTIZ-ALVAREZ; JÄGER, 2020).
Apesar das fortes associações observadas, existem lacunas importantes no conhecimento. A maioria das evidências sobre exercício e MV é indireta, e são necessários ensaios clínicos randomizados que testem diretamente o impacto de diferentes modalidades de exercício (ex: aeróbico vs. força, moderado vs. exercício intervalado de alta intensidade (HIIT, high-intensity interval training – HIIT)) na composição da MV (PRIETO et al., 2024). Da mesma forma, mais estudos de intervenção dietética controlados são necessários para estabelecer causalidade e otimizar recomendações nutricionais específicas para a saúde vaginal (ANTONIO; ORTIZ-ALVAREZ; JÄGER, 2020).
As evidências científicas atuais estabelecem uma conexão robusta e multifacetada entre a dieta, o exercício físico e a saúde da microbiota vaginal. Fica claro que as escolhas de estilo de vida transcendem seus benefícios conhecidos para a saúde metabólica e cardiovascular, exercendo uma influência direta e indireta sobre ecossistemas microbianos vitais para a saúde da mulher (HOLDCROFT; PAYNE; IRELAND, 2023; BERMON et al., 2015).
Os mecanismos subjacentes a essa relação são complementares. A nutrição atua de forma mais direta, fornecendo os substratos que nutrem as bactérias benéficas (fibras, micronutrientes) ou que favorecem o crescimento de patógenos (açúcares refinados, gorduras saturadas) (MORVARID et al., 2022). O exercício físico, por sua vez, age como um potente modulador sistêmico, otimizando o ambiente metabólico e inflamatório do hospedeiro, o que, por consequência, promove a estabilidade e a resiliência da microbiota vaginal (ANTONIO; ORTIZ-ALVAREZ; JÄGER, 2020).
A compreensão dessa interação oferece uma perspectiva de empoderamento, que desloca o foco do tratamento reativo de doenças para a promoção proativa da saúde. Ao adotar estratégias conscientes de nutrição e atividade física, as mulheres podem se tornar agentes ativas na manutenção de sua saúde ginecológica e geral, reforçando a ideia de que o bem-estar é uma construção diária, modulada por escolhas de estilo de vida acessíveis e eficazes (NIBALI; HENDERSON, 2016; KOCHHAR; MARTIN, 2015).
Referências
ADAMS, R. Probiotics: master of the microbiome. Natural Products INSIDER, 2018.
ANTONIO, J.; ORTIZ-ALVAREZ, L.; JÄGER, R. The athletic gut microbiota. Journal of the International Society of Sports Nutrition, [s.l.], v. 17, n. 1, p. 24, 2020.
BERMON, S. et al. The microbiota: an exercise immunology perspective. Exercise Immunology Review, [s.l.], v. 21, p. 70-79, 2015.
DE FILIPPO, C. et al. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proceedings of the National Academy of Sciences of the United States of America, v. 107, n. 33, p. 14691-14696, 2010.
HOLDCROFT, A. M.; PAYNE, M. S.; IRELAND, D. J. The vaginal microbiome in health and disease—what have we learned?. Physiological Reports, [s.l.], v. 11, n. 6, p. e15647, 2023.
JANG, L.-G. et al. The combination of sport, macronutrient and dietary fiber intake on gut microbiota. Journal of Exercise Nutrition & Biochemistry, v. 23, n. 4, p. 7-16, 2019.
KOCHHAR, S.; MARTIN, F.-P. (Ed.). Metabonomics and Gut Microbiota in Nutrition and Disease. London: Springer, 2015.
KOLIDA, S.; GIBSON, G. R. Prebiotic capacity of inulin-type fructans. The Journal of Nutrition, [s.l.], v. 137, n. 11, p. 2503S-2506S, nov. 2007.
LYTE, M.; CRYAN, J. F. (Eds.). The Gut-Brain Axis: Dietary, Probiotic, and Prebiotic Interventions on the Microbiota. Amsterdam: Elsevier, 2016.
MARCHESI, J. R. (Ed.). The Human Microbiota and Microbiome. Wallingford: CABI, 2014.
MENDLING, W. Vaginal Microbiota. In: SCHWIERTZ, A. (Ed.). Microbiota of the Human Body: Implications in Health and Disease. Cham: Springer, 2016. p. 83-93.
MIHALEVA, V. V.; ROSS, A. B.; MOCO, S. Computer-Aided Annotation of Flavonoid Conjugates in LC-MSn Datasets. In: KOCHHAR, S.; MARTIN, F.-P. (Eds.). Metabonomics and Gut Microbiota in Nutrition and Disease. London: Springer, 2015. p. 109-125.
MORVARID, M. et al. Association between dietary patterns and bacterial vaginosis: a case–control study. Scientific Reports, v. 12, n. 1, p. 1332, 2022.
NEGGERS, Y. H. et al. Dietary intake of selected nutrients affects bacterial vaginosis in women. The Journal of Nutrition, v. 137, n. 9, p. 2128–2133, 2007.
NIBALI, L.; HENDERSON, B. (Eds.). The Human Microbiota and Chronic Disease: Dysbiosis as a Cause of Human Pathology. Hoboken, NJ: Wiley Blackwell, 2016.
PARKE, D. V. et al. Role of the Gut Microbiota in Maintaining GI Health and the Link to IBD. In: KOCHHAR, S.; MARTIN, F.-P. (Eds.). Metabonomics and Gut Microbiota in Nutrition and Disease. London: Springer, 2015. p. 261-292.
PRIETO, I. P. et al. Physical activity and sedentary behavior as modulators of the human-associated microbiomes: A systematic review and meta-analysis. Journal of Science and Medicine in Sport, v. 27, p. 793-804, 2024.
QUEIPO-ORTUÑO, M. I. et al. Gut microbiota composition in male rat models under different exercise modalities: a randomized controlled trial. PLoS One, v. 8, n. 10, p. e76763, 2013.
RAVEL, J. et al. Vaginal microbiome of reproductive-age women. Proceedings of the National Academy of Sciences of the United States of America, v. 108, suppl. 1, p. 4680-4687, 2011.
RESTA-LENART, S. M.; BARRETT, K. E. Live probiotics protect intestinal epithelial cells from the effects of infection with enteroinvasive Escherichia coli (EIEC). Gut, v. 52, n. 7, p. 988-997, 2003.
SCOTT, K. P. et al. The influence of diet on the gut microbiota. Pharmacological Research, v. 69, n. 1, p. 52-60, 2013.
SHENDEROV, B. A. The microbiota as an epigenetic control mechanism. In: NIBALI, L.; HENDERSON, B. (Eds.). The Human Microbiota and Chronic Disease: Dysbiosis as a Cause of Human Pathology. Hoboken, NJ: Wiley Blackwell, 2016. p. 181-197.
SLAVIN, J. Fiber and prebiotics: mechanisms and health benefits. Nutrients, v. 5, n. 4, p. 1417–1435, 2013.
VERSTRAELEN, H. et al. Subclinical iron deficiency is a strong predictor of bacterial vaginosis in early pregnancy. BMC Infectious Diseases, v. 5, p. 55, 2005.




Comentários